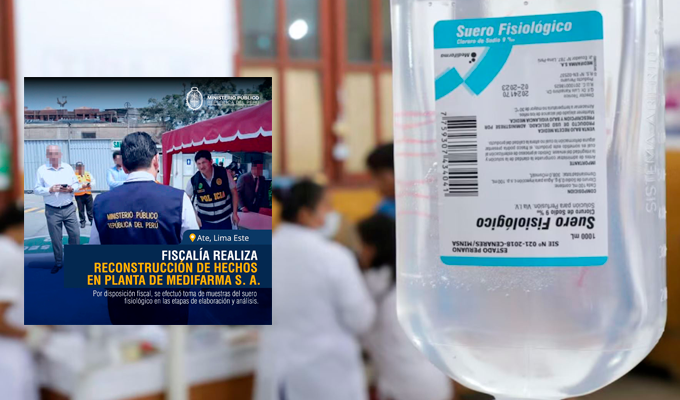
Luego de la crisis sanitaria desatada por el suero contaminado de Medifarma, que ha dejado hasta el momento cuatro personas fallecidas y otras cuatro con muerte cerebral, la Dirección General de Medicamentos, Insumos y Drogas (Digemid) realizó una inspección en los laboratorios de la farmacéutica. Según sus conclusiones, los lotes almacenados que encontraron en el momento de la verificación “están conformes”, descartando fallas en otros productos presentes en la planta.
Asimismo, el informe señala que “el software no permite alterar ni modificar el proceso” mediante el cual se fabricó el lote defectuoso que ocasionó la tragedia. Sin embargo, las áreas de producción de líquidos se encuentran paralizadas para la implementación de cambios en la automatización del control y registro del proceso de fabricación. Aún persiste la preocupación, pues cerca de 4,000 unidades del suero contaminado siguen sin ser ubicadas.
Inspección llegó después de las muertes
En paralelo, ha surgido una polémica respecto a una modificación en la normativa sobre el reporte de reacciones adversas a medicamentos. “En julio de 2022, las sospechas de reacciones adversas graves debían ser reportadas en 24 horas”, pero en noviembre de 2024 la norma cambió, ampliando el plazo a “siete días calendarios”. La resolución fue firmada por el ministro de Salud, César Vázquez, lo que ha despertado cuestionamientos sobre su impacto en la respuesta ante emergencias sanitarias.
El Ministerio de Salud (Minsa) se comunicó con Panorama para aclarar que “algunos de los cambios iban dirigidos a las farmacias”, aunque no especificaron si ello afectó el tiempo de reporte de eventos adversos. Mientras tanto, las familias de las víctimas exigen respuestas y advierten que esta modificación podría ser utilizada por los responsables como una estrategia legal para evitar sanciones.